의료기기 개발을 준비하고 있는 신규업체라면 달라진 제도를 잘 살펴야 한다.
식품의약품안전청은 신성장동력산업으로 주목받는 의료기기 분야의 세계적 경쟁력을 확보하기 위해 올해부터 추진하는 "Change & Jump 2010 의료기기 관리 선진화 방안"의 추진 상황을 정리한 ‘의료기기 규제개혁’ 리플렛을 발간한다.
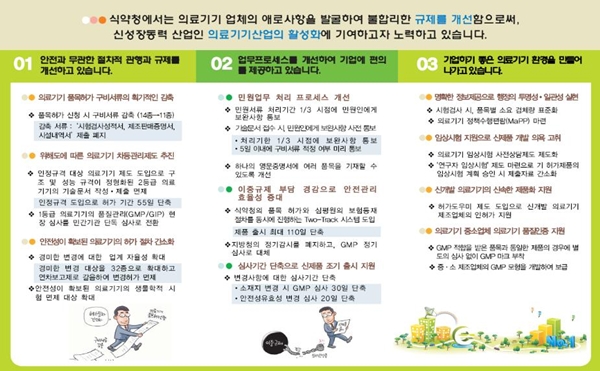
리플렛은 ▲안전과 무관한 절차적 관행·규제 개선분야 ▲업무 프로세스 개선으로 기업 편의 증진분야 ▲기업하기 좋은 의료기기 환경 구축분야 등 3개 분야로 구성됐다.
안전과 무관한 절차적 관행·규제 개선분야는 "행정구역 변경에 따른 제조원의 소재지 변경", "구성품 중 키보드, 스위치의 색상 변경" 등 경미한 변경 대상을 32종으로 확대했다.
또한 이들 변경사항을 연차보고제로 갈음해 변경허가를 면제하는 등 업계 자율관리 영역을 확대한다.
아울러 생물학적 안전성 시험이 면제되는 품목을 49개 품목에서 61개로 확대하고, 면제 대상 품목을 고시하던 것을 공고제로 전환해 업체가 이를 신속히 적용할 수 있도록 했다.
업무 프로세스 개선으로 기업 편의 증진분야는 의료기기 영문증명서 발급 시에 여러 품목을 하나의 증명서를 통해 발급받을 수 있도록 시스템을 개선했다.
또한 위해도가 비교적 낮은 1등급 의료기기의 GMP/GIP 현장심사를 심사기관 단독으로 실시하는 등 제도 개선을 추진했다.
기업하기 좋은 의료기기 환경 구축분야는 중·소 제조업체에 맞춤형 GMP 모형을 개발·보급하고, 위험관리 기반의 GMP 기술지원 사업을 실시했다.
또한 ‘약물방출스텐트, 로봇수술기, 모바일혈압계’ 등 첨단 기술 의료기기의 제품화를 위해 맞춤형 허가 지원 시스템을 마련하는 등 각종 지원을 추진한다.,
이 기사를 공유합니다

