
지난해 10월 7일, 스웨덴 왕립과학원 노벨위원회는 독일 막스플랑크연구소의 에마뉴엘 샤르팡티에 교수와 미국 캘리포니아대학교 버클리 캠퍼스의 제니퍼 다우드나 교수 등 2명의 여성 과학자를 노벨화학상 수상자로 선정했다.
노벨위원회는 “이 두 사람이 개발한 ‘크리스퍼 유전자 가위’ 기술이 생명과학에 혁명적인 영향을 미치고 있다”면서 “암을 비롯해서 부모로부터 물려받은 유전자 질환을 치료할 수 있는 길을 열어주었다”고 평가했다.
이 두 여성은 2011년 봄에 협업 연구를 시작하여 이런 놀라운 성과를 낳았다. 당시 에마뉴엘 교수는 바이러스에 감염된 화농연쇄상구균의 DNA 절단에 관한 연구를 진행 중이었고, 다우드나 교수는 세균이 바이러스 감염에 어떻게 대항하는가와 관련된 연구를 하고 있었다. 이들의 절묘한 궁합은 곧이어 인류의 진화 역사를 근본적으로 바꾸어놓을 연구 결과로 이어졌다.
‘크리스퍼(CRISPR)’라는 세균의 면역체계가 바이러스 DNA를 원하는 부위에서 정교하게 잘라내는 비밀을 알아낸 것이다. 이 비밀은 비록 단순해보이지만, 그것이 지닌 파급력과 잠재력은 상상을 초월하는 것이었다.
곧바로 연구 결과는 연구자 자신들도 전혀 예상하지 못했던 엄청난 규모와 급격한 속도로 전 세계의 과학계로 펴져갔다. 어느 면에서 이 업적은 1953년 DNA 이중나선 구조의 발견에 비견될 만한 획기적인 사건이 아닐 수 없었다.
‘크리스퍼’라는 유전자 편집 가위
본래 ‘크리스퍼(CRISPR)’는 세균 DNA의 한 영역을 일컫는 말이다. ‘clustered regularly interspaced short palindromic repeats’라는 긴 용어의 앞 글자를 땄다. 우리말로 ‘앞뒤가 동일한 서열인 회문(回文) 구조가 간격을 두고 반복되는 구조의 집합체’ 정도로 번역된다.
그 뜻의 난해함은 원문이든 번역문이든 다르지 않다. 어쨌든 이 말은 에마뉴엘과 다우드나 교수의 획기적인 연구 결과가 나온 이후 ‘크리스퍼 기술을 이용하는 유전자 가위’라는 뜻으로 확장되어 사용되기 시작했다.
유전자 편집 도구, 즉 유전자 가위는 크리스퍼가 처음은 아니었다. 최초의 제1세대 유전자 가위는 1996년 존스홉킨스대학교 스리니바산 찬드라세가란 교수가 만든 ‘징크 핑거 뉴클레이즈(ZFN)’였다. 그러나 이 가위는 워낙 만들기도 어렵고 비용도 많이 들어 널리 활용될 수 없었다. 효소를 재설계하는 일도 쉽지 않아서 다목적 도구로는 어울리지 않았다.
이후 ZFN을 보강한 제2세대 유전자 가위로 ‘TALEs 핵산가수분해효소(transcription activator-like effector nucleases)’, 즉 ‘탈렌(TALEN)’이 개발됐다. 상당한 주목을 받았던 탈렌은 그러나 개발되자마자 얼마 안 돼 강력한 제3세대 주자인 크리스퍼에게 밀려나고 말았다.
크리스퍼 이전의 제1, 2세대 유전자 가위는 섬세한 실험 기술과 뛰어난 과학 전문가, 대규모 연구 자금이 필요했고, 극히 제한된 수의 생물에만 적용할 수 있었다. 그러나 크리스퍼는 가이드 RNA만 바꾸어서 캐스9 단백질과 함께 세포에 주입하면 제 역할을 다하기 때문에 관련 연구자들은 물론이고 관심 있는 학생들까지도 원하는 대로 간편하게 사용할 수 있었다.
그랬기에 크리스퍼는 마치 빨간 펜으로 간단한 문장을 교정하듯이 살아 있는 생명체의 DNA를 수선하는 손쉬운 도구로 널리 이용되기 시작했다. 미생물이든 동식물이든, 사람을 포함한 영장류이든 가리지 않고 모든 생명체의 DNA 부위를 잘라내고 바꿔주기 때문에 모든 자물쇠를 여는 만능키에 비유할 수 있었다.
크리스퍼 기술의 민주화, 그리고 혁명
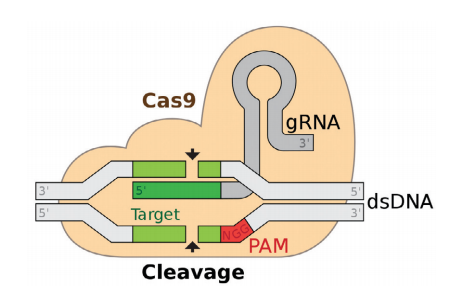
유전자 편집과 관련해서 많은 선행 연구들이 있었지만, 크리스퍼 혁명의 직접적인 도화선이 된 연구는 제니퍼 다우드나 교수팀이 2012년 6월 28일자로 <사이언스>에 발표한 논문이었다. 논문의 제목은 ‘세균의 적응면역에서 프로그래밍 가능한 이중 RNA가 안내하는 DNA 핵산내부가수분해효소(A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity)’였다.
당시 연구팀은 화농연쇄상구균에서 분리한 크리스퍼 연관 단백질(CRISPR-associated protein)인 캐스9(Cas9)가 20개 염기로 이루어진 표적 DNA를 찾아내어 자르기 위해서는 두 종류의 RNA(크리스퍼 RNA와 트레이서 RNA)가 필요하다는 점을 입증했다. 그리고 두 RNA를 하나의 가이드 RNA로 개량했다. 길잡이 역할을 하는 가이드 RNA가 표적 DNA로 안내한 캐스9가 가위 역할을 하는 방식이었다.
이처럼 크리스퍼 유전자 가위의 작동 원리를 규명한 이 논문에서 연구팀은 세균의 바이러스 면역체계인 크리스퍼가 유전자 편집 도구로 유용하게 사용될 수 있음을 분명하게 보여주었다. 더 나아가 연구팀은 논문 말미에서 “ZFN와 TALEN이 유전체를 조작하는 인공적인 DNA 절단 효소로서 상당한 관심을 끌고 있다”고 먼저 언급한 뒤에 “우리는 유전자 표적화 및 유전체 편집 분야에 상당한 잠재력이 있으면서 RNA로 프로그래밍이 가능한 캐스9에 기반한 방법을 그 대안으로 제시한다”고 선언했다.
이 논문이 발표된 이후 1년도 채 안 되어 세계의 많은 과학자들이 다루기 쉽고 값싼 크리스퍼를 이용하여 유전자를 자르고 붙이면서 눈부신 성과들을 내놓기 시작했다. 이렇게 불붙기 시작한 ‘크리스퍼 기술의 민주화’는 곧바로 ‘크리스퍼 혁명’으로 타올랐다. 지난 수십억 년 동안 무작위로 진화를 당해왔던 인류가 바야흐로 크리스퍼 기술을 손에 쥐게 된 시점을 계기로 모든 생명체의 진화를 인위적으로 통제할 수 있게 됐다.
주류 과학으로 떠오른 유전체 공학
2012년 크리스퍼 논문을 처음 발표할 무렵 이미 RNA 구조생물학 분야의 거장이었던 제니퍼 다우드나 교수는 크리스퍼 기술의 전파 속도에 놀랄 뿐이었다. 그는 2013년 여름부터 세계적으로 이 기술로 유전자가 편집된 생물과 세포의 목록을 작성하기 시작했다. 그러나 1년 반 쯤 지나면서 그 시도를 포기해야 했다. 추가되는 미생물과 동식물의 종류가 급증하면서 혼자 다 관리하기가 어려웠기 때문이다.
크리스퍼가 등장하면서 유전자 편집 분야는 강력해졌고 다양해졌다. 이제는 ‘유전체 공학(genomic engineering)’이라는 이름으로 불릴 정도로 주류 학문이 됐다. 지금 이 순간에도 이 분야는 그 실체를 파악하기 어려울 정도로 급격히 나아가고 있다.
본지가 <바이오테크롤로지의 미래> 주제로 특집을 준비하면서 고민했던 점도 급변하는 크리스퍼 혁명의 실체를 파악하기가 거의 불가능하다는 사실이었다. 그러다가 맞춤한 방편 하나가 발견됐다. 크리스퍼 기술의 개발자인 다우드나 교수가 직접 쓴 저작이 그것이었다. 그의 시각으로 이 주제에 접근한다면 상당히 객관적으로 실체에 다가설 수 있을 것만 같았다.
마침 2017년 다우드나 교수가 크리스퍼 연구를 중심으로 자신의 경험담을 쓴 <A Crack in Creation: Gene Editing and the Unthinkable Power to Control Evolution>이라는 책이 2018년 4월 <크리스퍼가 온다 - 진화를 지배하는 놀라운 힘, 크리스퍼 유전자 가위>(제니퍼 다우드나ㆍ새뮤얼 스턴버그 공저, 김보은 번역, 프시케의 숲 간행)라는 제목으로 국내에 출간됐었는데, 우선적으로 이 책에 기대보기로 했다.
올 3월에는 미국에서 스티브 잡스 전기로 잘 알려진 월터 아이작슨이 <코드 브레이커: 제니퍼 다우드나, 유전자 편집, 인류의 미래(The Code Breaker: Jenifer Doudna, Gene Editing, and the Future of the Human Race)>라는 제목으로 다우드나 교수의 전기를 펴냈다.
이 책 역시 그의 생애를 따라가면서 크리스퍼 기술을 이용한 코로나 백신의 개발까지 이어지는 유전체 공학 발전의 역사를 다루고 있다. 크리스퍼 기술을 둘러싼 특허 분쟁과 함께 유전자 가위 기술의 응용 가능성을 희망과 위험의 양면에서 조명한 부분도 흥미롭다. 국내에는 아직 번역되지 않았으나, 수입도서로 이용할 수 있다.

